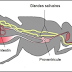
Cycle du
trypanosome
Le cycle de
transmission du parasite dans la nature paraît assez simple (figure 6). Tant qu'une
personne héberge des trypanosomes dans le sang, il reste une source de
contamination pour toutes les glossines qui le piqueraient. Les malades en 1ere
période représentent donc le réservoir de parasites le plus dangereux, d'autant
que, comme nous le verrons, ils ont peu de signes cliniques et ne se sentent,
le plus souvent, pas malades. Arrivés en 2ème période, les
trypanosomes disparaissent progressivement du sang et, du fait de la gravité de
la maladie, les malades vont de moins en moins travailler, ce qui diminue leur
exposition aux glossines.
Il peut exister
un cycle sauvage. La glossine se contamine et/ou contamine un animal, en
particulier le porc dans le cas de Trypanosoma brucei gambiense.
Infectée, à partir d'un animal, avec un trypanosome pathogène pour l'homme, la
glossine le lui transmettra lors d'un nouveau repas de sang. Ces animaux constituent
ce que l'on appelle le « réservoir animal » de la trypanosomose humaine.
Figure
6 : Cycle de transmission de Trypanosoma brucei gambiense [26].
Réponse
immunitaire
Dans le sang,
les trypanosomes se multiplient selon un rythme déterminé par la réponse
humorale de l'hôte, aboutissant ainsi à des vagues parasitémiques (figure 7).
Le trypanosome
se multiplie dans le sang, mais l'organisme de l'homme parasité réagit grâce à
son système immunitaire. Il crée des anticorps qui détruiront les trypanosomes,
ce qui aboutit à l'arrêt de leur multiplication puis à leur disparition presque
totale du système circulatoire. De son côté, le trypanosome se défend en se transformant
de telle sorte que les anticorps ne pourront plus le détruire. Il peut ainsi se
multiplier à nouveau, ce qui se traduit par une nouvelle vague parasitémique.
Le corps humain
réagit en produisant de nouveaux anticorps actifs contre la nouvelle forme
prise par les trypanosomes. La nouvelle vague est stoppée, disparaît et le
cycle recommence.
À chaque vague
parasitémique correspond ce qu'on appelle un variant antigénique. Entre chaque
vague, les parasites peuvent être indécelables par les techniques de diagnostic
courantes.
Le test le plus
employé pour le dépistage de la THA est le Card Agglutination Test for
Trypanosomiasis (CATT). Il est fabriqué à partir d'un variant antigénique
commun à la presque totalité des foyers et présente au début de la maladie (il
est souvent le variant de la « première vague » parasitémique), ce qui permet
des dépistages précoces. On l'appelle le variant LiTat 1.3.
Figure
7 : Vagues parasitémiques de Trypanosoma brucei [27].
Les humains ont
développé un système d’immunité inné particulier contre les trypanosomes
africains et seuls deux clones de Trypanosoma brucei (Trypanosoma
brucei gambiense et Trypanosoma brucei rhodesiense) peuvent résister
à cette défense et causent la maladie du sommeil. Deux protéines sériques
spécifiquement humaines ont été successivement présentées comme étant
trypanolytiques : la protéine apparentée à l’haptoglobine (haptoglobin-related
protein : Hpr) et l’apolipoprotéine L1 (apoL1). Le sérum humain normal contient
deux types de particules porteuses de ces deux protéines. Ces particules sont
respectivement une sous-fraction d’HDL appelée facteur lytique des trypanosomes
1 (TLF1) et un agrégat d’IgM appelée facteur lytique des trypanosomes 2 (TLF2).
Alors que Hpr est impliquée en tant que ligand de TLF, l’activité lytique est
due à apoL1, une protéine formant des pores.
Dans le cas de
TLF1, un processus d’absorption a été caractérisé. Lorsqu’elle est libérée dans
la circulation, l’hémoglobine (Hb) se lie à Hpr et, par conséquent, au TLF1.
A son tour, le
complexe Hpr-Hb se lie au récepteur Hb-haptoglobine (Hp) du trypanosome, il
s’agit d’un récepteur de surface dont la fonction est de permettre l’import
d’hème à partir de la dégradation d’Hb. En effet les formes sanguicoles du
trypanosome ont besoin d’hème pour alimenter des hémoprotéines, dont l’activité
permet au parasite de résister au stress oxydatif des macrophages.
Comme ce
récepteur ne distingue pas entre Hp et Hpr, les particules de lipoprotéines de
haute densité contenant Hpr du sérum
humain sont absorbées efficacement par le parasite, ce qui conduit à une
internalisation simultanée de l’hème tiré d’apoL1, de Hpr et de Hb. Une fois
dans le lysosome, l’apoL1 est ciblée vers la membrane lysosomale, où son
activité de formation de pores anioniques déclenche un influx d’ions de
chlorure du cytoplasme. L’effet osmotique lié à ce flux d’ions conduit à une
tuméfaction incontrôlée du lysosome, causant finalement la mort du parasite [28]
(figure 8 A).
Deux clones de Trypanosoma
brucei, appelés Trypanosoma brucei rhodesiense et Trypanosoma
brucei gambiense, ont réussi à résister à ce mécanisme de lyse et causent,
par conséquent, la maladie du sommeil chez les humains.
Le facteur
dominant responsable de la résistance de Trypanosoma brucei rhodesiense
a été identifié. Cette protéine, appelée « associée à la résistance au
sérum » (SRA), est une version tronquée de l’antigène majeur variable de
surface du parasite, la glycoprotéine variable de surface (VSG). Sans doute à
cause de sa nature déficiente, la SRA n’est pas ciblée vers la membrane du
plasma comme les VSG normales mais se retrouve dans le compartiment endosomal
tardif. A cet endroit, la SRA neutralise l’apoL1 par le biais d’interaction
avec son hélice du C terminal [29] (figure 8 B).
Il a été défini
des mutations de cette l’hélice qui empêchent l’interaction avec la SRA et
rendent donc ces versions mutantes de l’apoL1 capables de tuer Trypanosoma
brucei rhodesiense. De façon inattendue, Il a été découvert que des mutants
similaires existent dans la nature : chez les Africains et les Américains
d’origine Africaine, ces mutations protègent contre l’infection par Trypanosoma
brucei rhodesiense même à l’état hétérozygote, mais le prix à payer est une fréquence
particulièrement élevée de développement d’insuffisance rénale à l’état homozygote.
La sélection naturelle des mutations de l’apoL1 en dépit de leur caractère
délétère pour les reins souligne à quel point la lutte contre les trypanosomes
a été importante pour l’évolution de l’espèce humaine [30, 31] (figure 8 C).
Un mécanisme de
résistance a pu être récemment proposé pour Trypanosoma brucei gambiense. L’accroissement
de la rigidité membranaire des endosomes de
Trypanosoma brucei gambiense par une glycoprotéine spécifique de
ce parasite appelée TgsGP (Trypanosoma brucei gambiense specific glycoprotein) empêche l’apoL1 de former des
pores, et donc bloque la fuite ionique à l’intérieur du parasite qui conduirait
à sa mort. Dans ce mécanisme de résistance, l’apoL1 reste piégée dans les
endosomes suffisamment longtemps pour être dégradée, et le parasite reste
malheureusement actif [32] (figure 8 D).
Figure 8 :
§ A : Mécanisme de sensibilité de Trypanosoma brucei brucei
au sérum humain.
§ B : Mécanisme de résistance de Trypanosoma brucei
rhodesciense au sérum humain.
§ C : Mécanisme de sensibilité de Trypanosoma brucei
rhodesciense au sérum humain avec ApoL1 mutante.
§ D : Mécanisme de résistance de Trypanosoma brucei gambiense au
sérum humain [33].
T.b. :
Trypanosoma brucei ; ApoL1 :
Apolipoprotéine L1 ; Hb: Hémoglobine ; Hpr: protéine apparentée à
l’haptoglobine ; SRA : protéine associée à la résistance du sérum ;
TgsGP : Trypanosoma brucei gambiense specific glycoprotein ; HDL : Lipoprotéine
de haute densité.